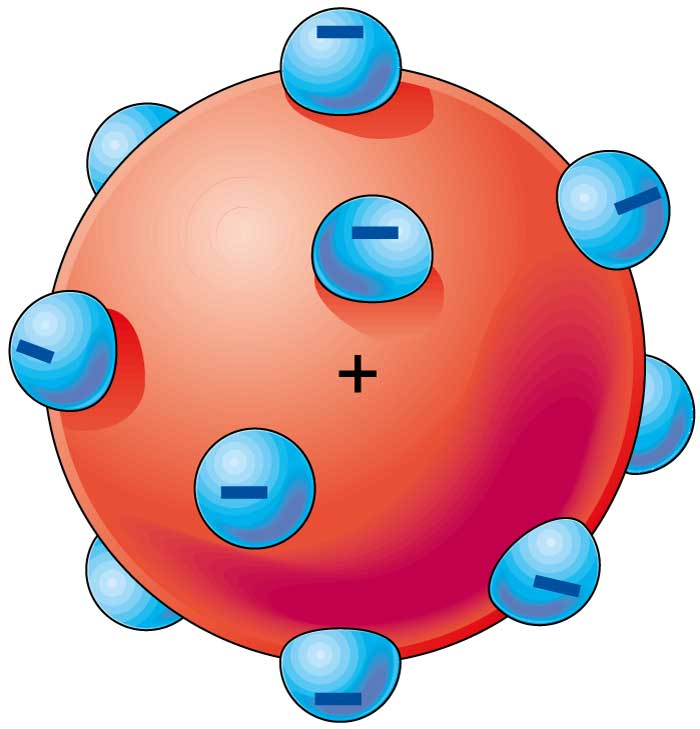
Después de que en 1987 J. J. Thompson confirmara experimentalmente la existencia del electrón, empezaron a surgir modelos teóricos de como podría ser el átomo, el primero después de este descubrimiento fue propuesto por el mismo Thompson, un modelo del átomo que suele ser llamado como el modelo del “panque con pasas” pues según Thompson el átomo estaba compuesto por una masa positiva espolvoreado con electrones de carga negativa esparcidos uniformemente sobre toda la masa de carga positiva, así la masa positiva parecía el panque y los electrones las pasas.
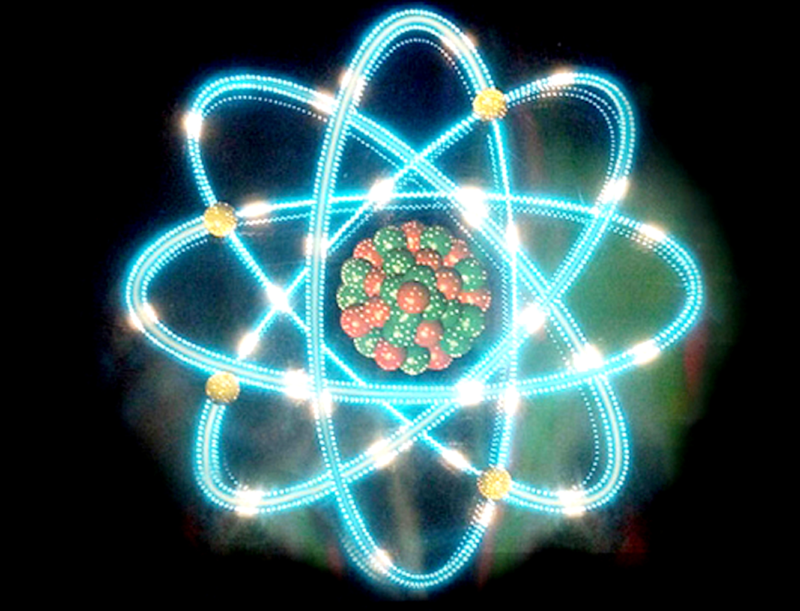
En 1911 un estudiante de Thompson; Ernest Rutherford llega a la conclusión que el modelo de su maestro no es correcto y propone un nuevo modelo, el modelo de Rutherford. Este modelo atómico es el más conocido en el sentido en que es el que más solemos ver en ilustraciones artísticas y en caricaturas (por ejemplo el logo de Jimmy Neutron), este modelo nos dice que el átomo está formado por un núcleo positivo(compuesto por protones y neutrones) y electrones orbitando este núcleo, sin embargo, este modelo tenía grandes contradicciones con la teoría electromagnética , comprobada experimentalmente muchísimas veces, y además no explicaba los espectros atómicos, estás incongruencias dieron pie al modelo atómico de Bohr.
También lee: LA CONSERVACIÓN DE LA ENERGÍA
Así como el maestro de Rutherford fue Thompson, el maestro de Bohr fue Rutherford, 3 científicos que a su respectivo tiempo trataron de darle una explicación a como es en realidad un átomo. En 1913 Bohr propone un nuevo modelo atómico basado en el de Rutherford, este modelo proponía en esencia lo mismo que el de Rutherford, electrones de carga negativa orbitando alrededor de un núcleo positivo formado por protones y electrones, sin embargo, este nuevo modelo daba una explicación a las incongruencias que presentaba el modelo de Rutherford, incorporando la teoría de la cuantización de la energía y el fenómeno del efecto fotoeléctrico. Este nuevo modelo nos dice que tanto las orbitas en las que giran los electrones alrededor del núcleo como la energía que liberan está definida por un número cuántico. Es decir, que tanto las orbitas como la energía están cuantizadas.
Si pensamos que los electrones en el átomo no están conectados con el núcleo, que están separados por un espacio vacío entonces es imposible que estén quietos, por eso forzosamente tienen que estar en movimiento, sin embargo, la teoría electromagnética dice que una carga en movimiento libera energía, es por eso que el modelo de Rutherford presentaba problemas, porque en su modelo el electrón no liberaba energía, Bohr lo soluciona diciendo que siempre el momento angular del electrón tiene que ser múltiplo de la constante de Planck entre 2π es decir
L=nh/2π
Donde L es el momento angular y h la constante de Planck y la n es el número cuántico, que solo puede tomar valores enteros positivos, es decir 1,2,3 etc. Por lo que el electrón solo puede girar en algunas orbitas ya establecidas, en el modelo de Bohr el electrón no libera energía mientras se quede en la misma orbita, libera energía cuando cambia de orbita, pero ¿cómo puede cambiar de orbita si solo puede estar en unas cuantas? Es decir, supongamos que eres un electrón dentro de un átomo, tú cama es el núcleo, y como obedeces el modelo de Bohr entonces solo puedes estar a cierta distancia de tu cama, supongamos que en tu casa y que están conectadas por un solo camino tu recamara, la sala y la cocina, supongamos que las orbitas en las que puedes estar son solo tu recamara y la cocina, es decir, no puedes estar en la sala, si estás en la cocina y quieres llegar a tu recamara tendrías que pasar por la sala, pero como eres un electrón que obedece el modelo de Bohr entonces repentinamente de estar en la cocina pasas a estar en tu recamara sin pasar a la sala, así, los electrones pasan de estar en su segunda orbita a estar en su primera orbita sin pasar por el espacio que hay entre estás orbitas, a esto se le conoce como salto cuántico, y al hacer este salto cuántico es cuando se libera (o se absorbe) energía y ciertamente la energía liberada depende del número cuántico y cuántas orbitas sean saltadas.
El número cuántico puede ir de 1 hasta infinito teóricamente, sin embargo, en los átomos conocidos, los átomos que se encuentran en la tabla periódica, los números cuánticos para las orbitas de los electrones solo toman valores entre 1 y 8, pues solo se han observado hasta 8 orbitas en un solo átomo. Pero como dato adicional si imagináramos al sistema solar como un átomo y los planetas como sus electrones, entonces el número cuántico que caracterizaría la órbita terrestre sería aproximadamente n=256×1072 un número extremadamente grande, se trata de un 256 seguido de 72 ceros, y la energía que liberaría si la tierra diera un salto cuántico por ejemplo a la órbita de Venus entonces la energía liberada sería catastrófica.